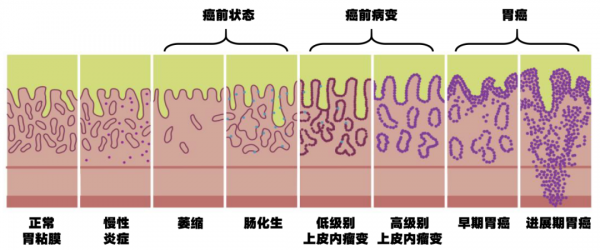
不少人一听“胃癌”这个字眼,便心生恐惧。 胃癌作为在我国消化系统恶性肿瘤中发生率和死亡率排名第一的疾病,严重威胁中国人群健康。根据世界卫生组织发布的2020年癌症负担数据显示,全球每年新发胃癌病例约120万,中国约占其中的40%。 2020年我国胃癌新发478508例,发病率约33.06/10万,它的防治是我国恶性肿瘤防控面临的重大挑战。影响胃癌的预后最关键的因素在于发现肿瘤的时机,早期胃癌的预后良好,五年生存率在90%以上,而进展期胃癌患者的五年生存率仅为20~30%。 什么是早期胃癌、胃癌前病变和癌前状态? 胃癌的发生、发展是一个多阶段、多步骤、逐渐进展的过程。通常由一系列的胃癌前疾病,如萎缩性胃炎、胃溃疡等发展而来。经典的肠型胃癌发生发展过程是:正常胃黏膜-慢性非萎缩性胃炎-慢性萎缩性胃炎-肠化生-上皮内瘤变(异型增生)-胃癌。 早期胃癌指癌组织限于胃黏膜层及黏膜下层,而未侵及固有肌层,无论病灶大小及是否局部淋巴结有转移的胃癌。早期胃癌患者手术(或内镜下切除)后5年生存率可达90%~95%,对于病变局限于黏膜内的早期胃癌效果更好。 我们通常将胃癌前情况其分为胃癌前状态(即胃癌前疾病,伴有或不伴有肠上皮化生的慢性萎缩性胃炎、胃息肉、胃溃疡和残胃及Menetrier病等)和癌前病变(即异型增生)两部分。其中异型增生,也称为上皮内瘤变,是需要我们关注的一个危险信号。研究发现轻、中、重度异型增生的癌变率分别约为2%、10%,25-50%。我们知道,我国普通人群的胃癌发生率约为万分之3,相当于高了100倍。 另外,患有慢性萎缩性胃炎伴肠化生的人群,其胃癌发生率是相对较高的,大约比普通人群高出3-10倍左右。需要指出的是,患有慢性萎缩性胃炎伴肠化并不都会发展为胃癌,也有一部分人可以长期保持稳定,不发生癌变。生活方式、饮食习惯、遗传因素等都是胃癌发生的危险因素。 早期和进展期胃癌会有哪些临床表现? 通常来说,早期胃癌患者常无特异的症状,随着病情的进展可出现类似胃炎、溃疡病的症状,主要有: 01、上腹饱胀不适或隐痛,以饭后为重。 02、食欲减退、嗳气、反酸、恶心、呕吐、 黑便等。 进展期胃癌除上述症状外,患者常出现: 01、体重减轻、 贫血、乏力。 02、胃部疼痛,如疼痛持续加重且向腰背放射,则提示可能存在胰腺和腹腔神经丛受侵。胃癌一旦穿孔,可出现剧烈腹痛的胃穿孔症状。 03、恶心、呕吐,常为肿瘤引起梗阻或胃功能紊乱所致。贲门部癌可出现进行性加重的吞咽困难及反流症状,胃窦部癌引起幽门梗阻时可呕吐宿食。 04、出血和黑便,肿瘤侵犯血管,可引起消化道出血。小量出血时仅有大便隐血阳性,当出血量较大时可表现为呕血及黑便。 05、其他症状如腹泻(患者因胃酸缺乏、胃排空加快)、转移灶的症状等。晚期患者可出现严重消瘦、贫血、水肿、发热、 黄疸和恶病质。 胃癌的危险因素有哪些? 胃癌的发生发展是多种因素共同作用的结果。其中,幽门螺杆菌(Hp)已经被 WHO 列为人胃癌的第Ⅰ类致癌原。 Hp感染胃黏膜时,会产生多种毒素和代谢产物,可以损伤胃黏膜,引起炎症,同时菌体细胞壁抗原能够引起自身免疫反应,多种机制使炎症反应迁延或加重,进而导致细胞的异常增殖和分化,增加癌变风险。长期高盐饮食、烟熏煎炸食品、红肉与加工肉的摄入及不良饮食习惯,吸烟、重度饮酒以及一级亲属胃癌家族史均是胃癌的危险因素。 胃癌的高危人群有哪些? 胃癌高危人群一般指年龄 40 岁及以上,且有胃癌高发区、Hp感染、既往胃癌前疾病(慢性萎缩性胃炎、胃溃疡、胃息肉、手术后残胃、肥厚性胃炎、恶性贫血等)、胃癌患者一级亲属、存在胃癌其他高危因素(如摄入高盐、腌制饮食、吸烟、重度饮酒等)的人群。 感染了Hp该怎么办? 我国Hp感染率较高,体检很多人会发现Hp感染。Hp感染是一种可传染的感染性疾病,有家族聚集性,也是胃癌最重要、可控的危险因素。因此除非有抗衡因素,Hp感染者都应考虑接受根除治疗。 有两类疾病强烈推荐根除Hp:消化性溃疡和胃MALT淋巴瘤。如有胃部症状、胃炎、胃息肉、胃癌家族史等也建议根除治疗。《2022第六次全国幽门螺杆菌感染处理共识报告》推荐Hp根除治疗方案为铋剂四联方案,周期为14天。治疗期间如果出现发热、皮疹、或其他药物不良反应,需及时咨询医生寻求帮助,必要时停药;注意就餐卫生,共同居住的人群分餐筷,同时,同居人群需筛查Hp。 早期胃癌有哪些检查手段 早期胃癌的检查手段主要包括内镜检查、影像学检查、血清学检查和尿素呼气试验等,通过多种手段结合应用能够更好地发现早期胃癌,及时治疗。胃镜及内镜下活检是目前诊断胃癌的金标准。近年来无痛胃镜发展迅速,极大程度上提高了胃镜检查的患者舒适度。对于高危人群建议高清染色内镜检查。 其他检查,包括: ①肿瘤标记物:如癌胚抗原(CEA)、CA72-4和 CA19-9等可以作为胃癌辅助诊断肿瘤标志物。但这些指标在早期胃癌中的阳性率太低,对早期胃癌的诊断价值有限,联合检测有助于降低胃癌漏诊率。 ②血清胃蛋白酶原PG检测、血清胃泌素-17等,可用于慢性萎缩性胃炎、胃癌人群初筛及风险分层。 ③ 无创Hp感染检测,如C13或C14呼气试验,已成为必要的筛查方法之一。 ④影像学检查:如X线气钡双重造影、超声、CT、MRI等,有助于发现胃内的溃疡或隆起病灶,评判胃癌病变范围,以及判断是否有肿瘤转移,如肝转移、淋巴结转移等。 多久做一次胃镜 癌前状态的进展程度同胃癌家族史一样,被认为是胃癌的危险因素之一。 对于局限于胃窦的生理性轻中度萎缩性胃炎患者,无需复查胃镜; 局限于胃窦的病理性轻中度萎缩性胃炎患者,建议每3年复查胃镜; 对于单一黏膜部位肠化生伴胃癌家族史、或存在顽固Hp相关胃炎的患者,可考虑3年内复查胃镜; 对于伴有肠化生的轻中度萎缩性胃炎患者,可每2-3年复查胃镜; 对于累及全胃的重度慢性萎缩性胃炎伴肠化生患者,则建议每1-2年复查高清胃镜。 高清染色内镜显示边界不清的低级别上皮内瘤变建议每年复查高清染色内镜,边界清晰、未行内镜治疗的低级别上皮内瘤变建议每6个月复查高清染色内镜。高级别上皮内瘤变癌变率最高,应立即确认病理,必要时复查高清染色内镜,及时行手术切除治疗。 什么是ESD 手术 ESD术(内镜下黏膜剥离术Endoscopic submucosal dissection)是指在内镜下将病变黏膜从黏膜下层完整剥离的微创技术。 内镜下黏膜剥离术(Endoscopic submucosal dissection,ESD) A,病灶周缘标记; B,黏膜下注射; C、Dual刀切开周缘; D、在切口处用IT刀切缘; E、IT刀圆周切缘; F、IT刀黏膜下剥离 ESD术已成为无淋巴结转移风险的早期胃癌患者的首选治疗方式,适用于胃肠道早期肿瘤的诊断和治疗,可以一次性完整切除一定面积表浅病变,具有创伤小、恢复快、费用低和并发症少等优势,与传统手术相比,ESD只是局部切除黏膜,对全身的状态几乎没有影响,相对并发症出现的少。 ESD 手术适应症 适用于胃肠道巨大平坦型息肉(直径>2cm)、黏膜下肿瘤、早期癌(局限于黏膜内、没有淋巴结转移)。 对于早期胃癌,ESD适合人群包括: 第一,是分化型的黏膜内癌如果表面没有形成溃疡,则病变大小不受限制。 第二,如果表面已经形成溃疡的分化型黏膜内癌,病变直径在3厘米以下。 第三,是未分化型的黏膜胃癌如果表面没有形成溃疡,病变直径在2厘米以下。 第四,胃黏膜高级别上皮内瘤变,及内镜下边界清晰的低级别上皮内瘤变。 ESD 手术后患者注意事项 术后应该遵循医生的建议,逐渐恢复饮食,并避免过于刺激性的食物;术后避免剧烈运动或重体力劳动;保持健康积极的心态有利于疾病的恢复。 胃癌ESD术后会复发吗 针对治愈性切除的患者,仍存在潜在的复发风险。其局部复发率约为1%,5年、10 年累积风险率高达10% 和20%。规律的高质量内镜随访可发现95%以上的异时癌。对于已行内镜下治疗的上皮内瘤变或早期胃癌,建议治疗后3-6个月复查高清染色内镜,并按照胃黏膜的基础状态确定随访间隔。同时应每隔一年进行腹部超声、CT等影像学检查。 复发及处理:对于随访过程中出现复发的患者,经评估可再次行 ESD 或外科手术治疗。而对于原位复发的患者,原切除创面瘢痕形成,粘连明显,建议由具有丰富治疗经验的专家再次尝试 ESD 切除,必要时行外科治疗。 转自:浙大二院 —————————————————————————————————————————— 感想:现在有胃病的童鞋越来越多,一定要多注意啊。 | ||
-
- 风霁。2023-08-15+33 派派币
- 趣味科普主持人奖励
- 倒序阅读 只看楼主
-